AI × ロボット駆動で次世代の細胞医薬品製造を実現する

AI × ロボット駆動で次世代の細胞医薬品製造を実現する
細胞医薬品の研究・開発では、長期間かつ複雑な培養工程ゆえに品質や成果のばらつきが生じやすく、実用化の大きな壁となっています。こうした課題に対し、アステラス製薬は Robotic Biology Institute(RBI)やエピストラと連携し、AIとロボティクスを融合した次世代型のプロセス開発に挑みました。従来の開発プロセスの限界を超えるために、どのような試行錯誤があったのか──今回は、本プロジェクトを主導されたアステラス製薬 CMCディベロップメント 原薬研究所 バイオロジカルテクノロジー リードの井上敦さまに、プロジェクトの背景と取り組みの成果についてお話を伺いました。
細胞培養の「ばらつき」がプロセス開発の壁だった
ー まず、プロジェクトをはじめるにあたっての背景や課題について教えてください
私たちがこのプロジェクトを立ち上げた背景には、細胞培養における再現性の確保という、根本的かつ深刻な課題がありました。
細胞は生きた材料であるため、わずかな操作の違いでも結果に大きな影響を与えることがあります。特に数週間から数ヶ月におよぶ長期培養では、そうした微細な差異が積み重なり、最終的なアウトカムを大きく左右することになります。
しかも、変化の要因となるのは、記録に残らない些細な手技や判断の違いであることが多く、問題が発生したとしても、その原因を正確に特定するのは困難です。そのため、従来の方法では、開発スピードや品質の安定性にどうしても限界がありました。
こうした課題に対処するため、まずはロボットを導入して手技の標準化を図り、誰が、いつ、どのように実施しても同じ結果が得られる、再現性の高い培養環境を構築しました。このロボットのプラットフォームは、もともと私たちアステラスがRBIと連携して進めていたものであり、今回のプロジェクトではその仕組みを活用しています。
ただ、このプラットフォームのポテンシャルを最大限に引き出すためには、得られた高精度なデータを有効活用できるAIとの連携が必要不可欠だと考えました。そこで、AIによる条件最適化で豊富な実績と専門知識を持つエピストラさんにも加わっていただき、三者による共同プロジェクトとして本格的に取り組むこととなりました。
実験自動化で「ばらつき」の壁を乗り超える
ー まさに、そうした熟練者に依存しない再現性の高いプロセスを目指すことが出発点だったと思います。ロボットの導入によって、実際にどのような変化が生まれたのでしょうか?
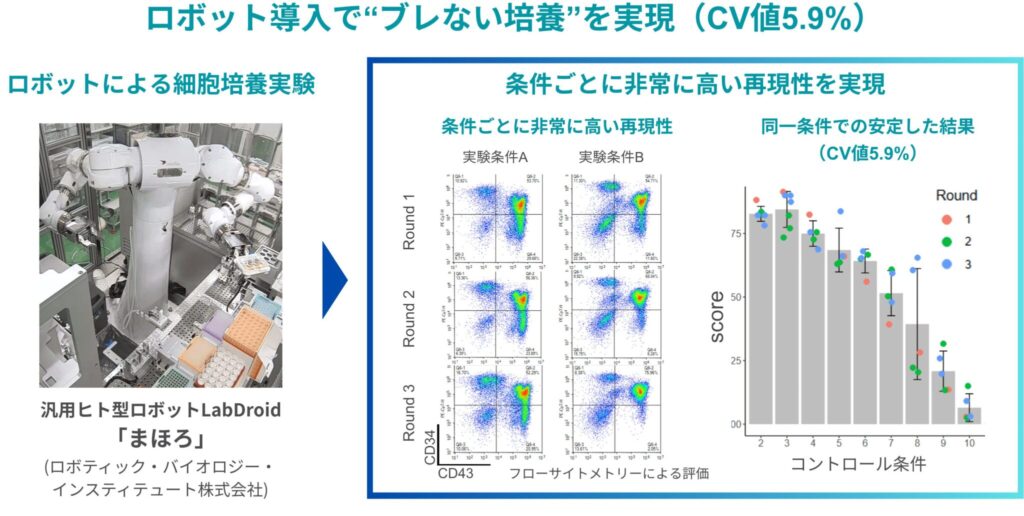
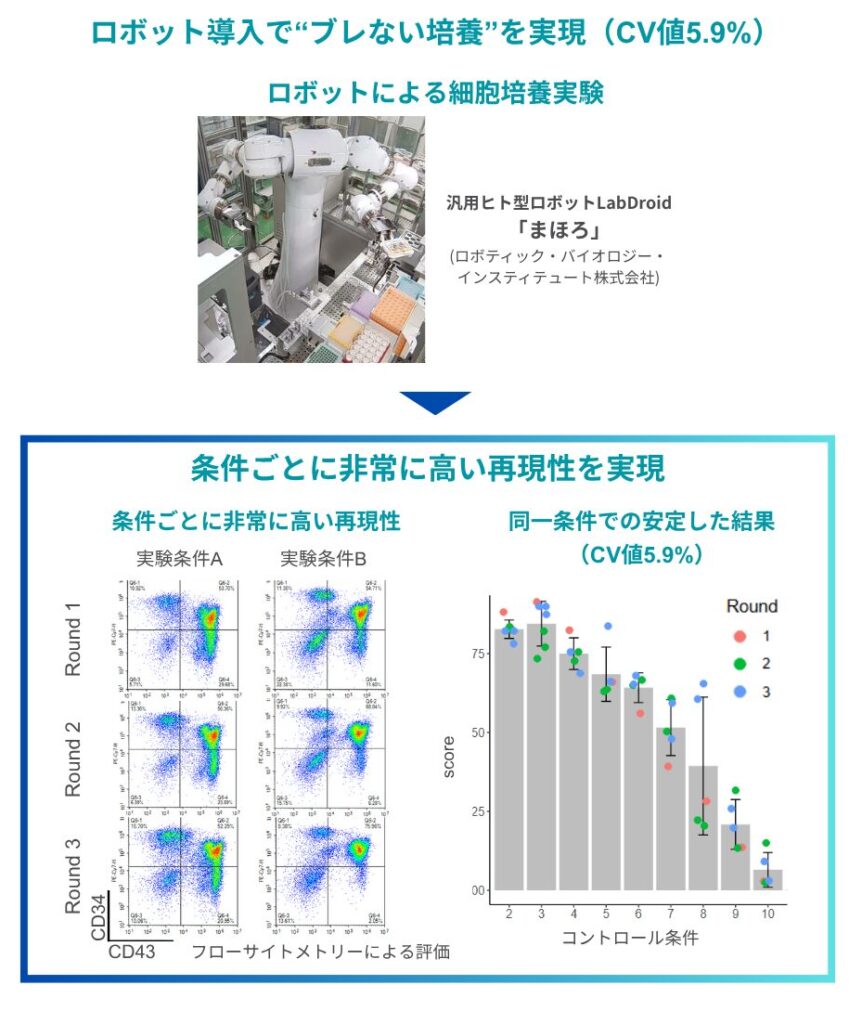
私たちが扱っている細胞の培養期間は90日以上に及ぶため、その間すべての操作を再現性高く維持し続けることは、人の手だけでは現実的にほぼ不可能です。操作のタイミングや条件のわずかな違いが結果に直結するため、ロボットのように正確で一貫した作業を、安定して続けられることが必要不可欠でした。実際、通常の手作業による培養実験では、20%を超えるばらつき(CV値)が出ることも珍しくありません。それに対して、今回ロボットを使って実施した予備検討ではCV値が5.9%という非常に高い再現性が得られました。このように、まず、「ブレない培養」を実現できたことが、プロセス開発全体の出発点として非常に重要だったと感じています。
再現性あるデータでAIが進化する──ロボットとAIのシナジー
ー そうして「ブレない培養」という基盤が整ったことで、いよいよ次のステップとして、AIによる条件の最適化に着手されたわけですね。実際にAIと連携することで、どのような成果が得られたのでしょうか?
まさにここからが、プロセス開発の常識を大きく変える転機だったと思います。
従来の方法では、これまでの経験や限られた文献に頼り、試行錯誤を重ねながら最適な培養条件を見つけ出す必要がありました。一方で、長期間の培養工程には検討すべきパラメータが無数に存在し、そのような高次元空間を従来の試行錯誤的なアプローチで探索することには限界を感じていました。
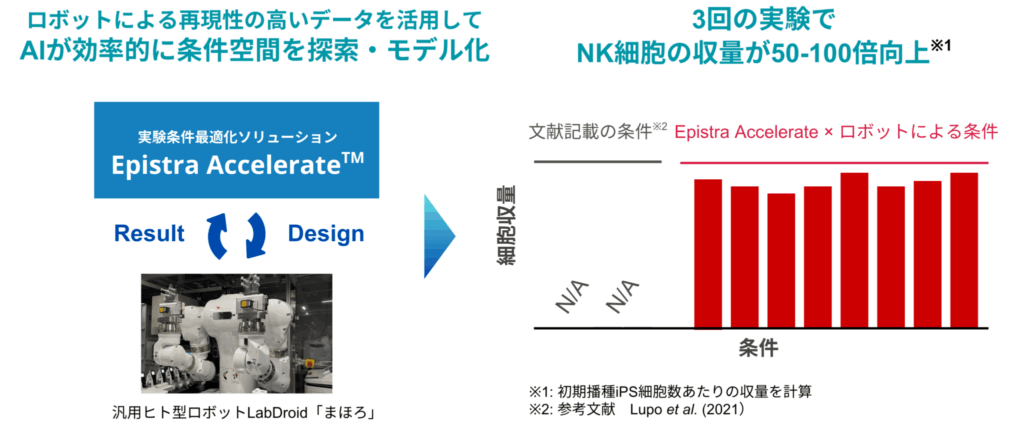
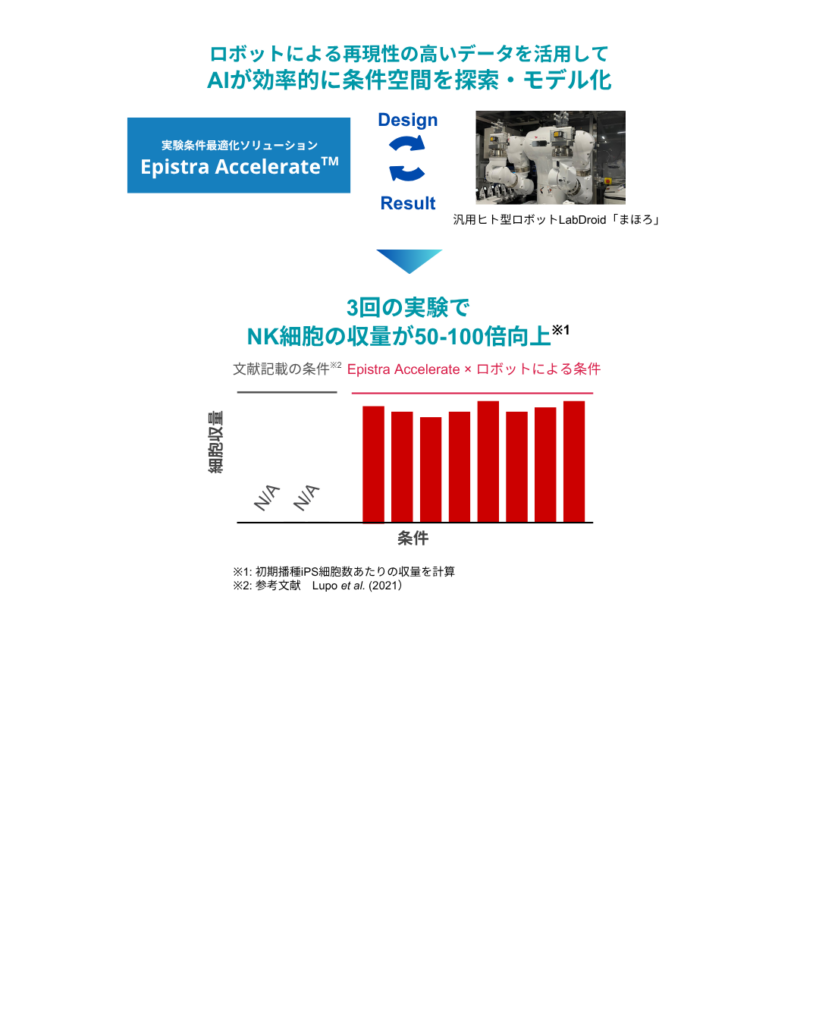
そこで今回、エピストラのAIを活用して条件の探索を行ったところ、予想をはるかに超える成果が得られました。文献に報告されている優れた結果と比較しても50倍から100倍という非常に高い収量を達成する条件を、3ヶ月という短期間で複数見つけることができました。
この結果は、従来は年単位で取り組んでいた工程開発を、限られた実験数で効率的に進めることで、大幅に加速できる可能性を示したものとなりました。AIとロボットを組み合わせた新しいプロセス開発のアプローチが実際に成果に結びついたことは、今後の大きな指針になると感じています。
(小澤) AI単体では限界がありますが、ロボットと組み合わせることで、高精度かつ再現性の高いデータが安定して得られるようになり、それによってAIモデルの精度も大きく向上しました。この相乗効果が、今回の成果につながったのだと思います。ばらつきのない良質なデータと、高次元空間を効率よく探索できるAIという組み合わせは、細胞医薬品のプロセス開発において非常に強力だと実感しています。

右:アステラス製薬株式会社 井上敦 様
左:エピストラ株式会社 CEO 小澤陽介
AIとロボットを組み合わせることで、プロセス開発の初期からQbDを見据えた検討を行える新たなアプローチが生まれた
ー 今回のプロジェクトを通じて、もともと想定していた成果に加えて、「ここまでできるとは」と感じられたような意外な展開や、印象に残っていることがあれば教えていただけますか?
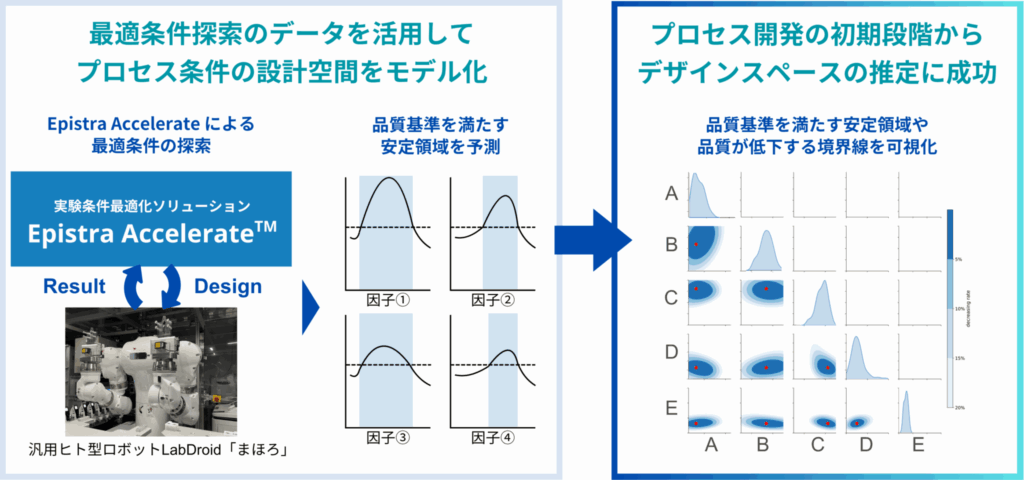
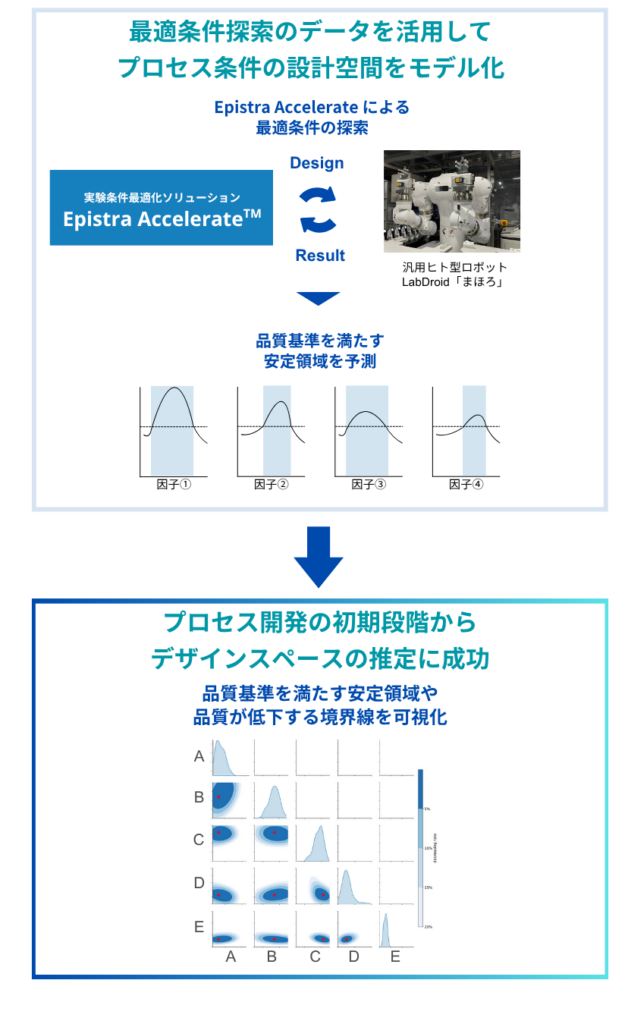
一つ挙げるとすれば、エピストラのAIによって、プロセス開発のごく初期の段階から、有効な条件範囲――いわゆるデザインスペースそのものを推定できた点です。
従来の手法でも統計的なアプローチは用いられますが、扱える因子数や実験数にはどうしても制約があり、広範囲を一度に俯瞰することは困難でした。また、設計の初期段階では仮説に基づく絞り込みが必要となるため、探索の柔軟性に限界がありました。
今回の取り組みでは、AIが限られた実験データから因子間の関係を含む構造を学習し、デザインスペースの推定までを自動でに行ってくれました。もちろん、推定結果の確からしさには今後の検証が必要ですが、プロセス開発の初期段階からデザインスペース、QbD(Quality by Design)を意識した検討がスタートできたことは非常に大きな成果だったと感じています。
FDAをはじめとする各国の規制当局が推奨する品質保証の考え方であるQbDは、GMP準拠の製造設計において、その重要性がますます高まっています。AIとロボティクスを活用した新しいアプローチは、このQbDをより早期の段階から実現するための有効な手段となり得ると考えています。
今回の成果を踏まえ、AIが設計初期からの判断支援にも貢献し得る可能性について、引き続き皆さんとともに検討を深めていければと考えています。
(小澤) そう言っていただけて光栄です。まさに私たちが実現したかったポイントでもあります。エピストラのAIは、ベイズ最適化をベースにしています。最適化の背後には「ガウス過程(GP)」と呼ばれる予測モデルがあり、観測データから関数の形状を学習し、各条件における期待される結果や不確実性を推定することができます。この仕組みにより、単に最適条件を見つけるだけでなく、「どの範囲の条件が良好な結果を生みやすいか」といった、デザインスペースに相当する領域を確率的に推定することも可能になっています。
AIとロボットが融合した仕組みを広げ、細胞医薬品が人々へ届く社会の実現へ

ー 今回の成果について、どのような反響がありましたか?
社内外から非常に大きな反響がありました。「自分たちのプロジェクトでも使ってみたい」「どうやっているのか知りたい」といった声が多数寄せられています。
特に、ばらつきのない再現性の高いデータを基盤に、短期間で論文をはるかに上回る収量改善が実現できたことに対し、驚きと関心が集まりました。CV値5.9%、ロット間でも安定というデータは、「細胞は完全にはコントロールできないのでは」と思っていた私たちの意識を大きく覆すものでした。
ー 最後に、今回の取り組みを踏まえて、今後どのようにこの仕組みを展開していくご予定でしょうか?
はい。今後はプレスリリースにもあるとおり、「まほろ」とAIを活用したこのプロセス開発の仕組みを、細胞医療製品の製造プラットフォームとして展開していきます。特にアカデミアやスタートアップの方々が持つ細胞医薬品のシーズに対して、我々のプラットフォームを提供し、製造プロセスの開発からGMP準拠の製造まで、一貫して支援できる体制を構築していきたいと考えています。
細胞医薬品の実用化を阻む壁のひとつに、「良いシーズがあっても、再現性あるプロセスを構築できない」というギャップがあります。今回の取り組みは、そのギャップを乗り越えるためのひとつの答え――ロボティクスによる再現性の確保と、AIによる条件最適化を組み合わせた新たなプロセス開発のアプローチ――を提示できたのではないかと感じています。
再生医療を社会に実装するためには、単なる自動化にとどまらず、細胞の品質を安定的に保ち、持続的に提供できる仕組みを確立することが不可欠です。そうした仕組みを実現するには、プロセスの初期段階から本質的な課題に向き合い、AIを活用して条件を的確に絞り込んでいくアプローチが重要になります。このような取り組みは、今後AI技術のさらなる進化とともに、ますます加速していくと考えています。
今回のような取り組みが進むことで、「再生医療の実用化」という社会的な課題に一歩ずつ近づけると感じています。同時に、製造プロセスの高度化にもつながり、治療をより確実に患者さんへ届けるための仕組みの構築にもつながっていくのではないでしょうか。
そうした変化を現実のものにしていくためには、これまで培ってきた技術を特定の企業の中にとどめず、より多くの研究者や開発者が活用できるかたちで社会に還元していくこと。これこそが、次世代の細胞医薬品開発を現実のものとし、ひいては患者さんに届けるために私たちが果たすべき役割だと考えています。
その未来を、私たちは本気で目指していきます。
今回お話を伺った方


アステラス製薬株式会社
CMCディベロップメント 原薬研究所
バイオロジカルテクノロジー リード